miR-142-3p alleviates house dust mite-induced airway inflammation among children
-
摘要:
目的 探索miR-142-3p在减轻尘螨诱导的儿童过敏性气道炎症中的作用,为解析儿童过敏性气道炎症发病机制提供新思路。 方法 于2022年9—11月在江南大学附属中心医院收集15例尘螨过敏哮喘患儿和15例健康儿童血清,采用荧光定量聚合酶联反应(PCR)法检测血清中miR-142-3p表达水平。采用酶联免疫吸附试验(ELISA)法检测细胞培养上清液中炎症因子白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)表达水平,采用荧光定量PCR法和Western blotting法检测高迁移率族蛋白B1(HMGB1)基因和蛋白表达水平。应用双荧光素酶报告基因系统评估miR-142-3p对HMGB1的靶向调控,采用Western blotting方法技术检测miR-142-3p干预后人正常肺上皮细胞(BEAS-2B)中下游调控蛋白表达。选择6~8周龄雌性C57BL/6小鼠,随机分为磷酸缓冲盐溶液(PBS)阴性对照组、尘螨致敏气道炎症组和尘螨致敏气道炎症+miR-142-3p干预组;采用苏木精-伊红(HE)染色评估小鼠气道炎症反应,应用瑞氏-吉姆萨染色和ELISA法检测支气管肺泡灌洗液(BALF)中炎症细胞和炎症因子表达水平。 结果 尘螨过敏哮喘患儿血清miR-142-3p表达水平较健康儿童血清降低(1.33±0.21,4.74±0.62,t=5.22,P<0.05)。粉尘螨粗提液(DFE)刺激BEAS-2B细胞后,miR-142-3p表达水平降低了(0.82±0.25);转染miR-142-3p后,其表达水平提升了(0.55±0.14)(t值分别为3.31,3.94,P值均<0.05)。miR-142-3p预处理可使DFE刺激后BEAS-2B细胞中炎症因子IL-6和TNF-α表达水平均降低(2.25±0.46,6.58±1.95)(t值分别为4.86,3.38,P值均<0.05);BEAS-2B细胞中miR-142-3p通过负调控HMGB1表达,降低下游调控蛋白Toll-样受体4蛋白(TLR4)和核因子-κB(NF-κB)表达。小鼠致敏模型显示miR-142-3p能够减轻尘螨致敏小鼠肺组织炎症细胞浸润;并且使尘螨致敏小鼠BALF中炎症因子白细胞介素-4(IL-4)、白细胞介素-5(IL-5)、HMGB1水平均降低[(107.60±10.43)pg/mL,(95.78±13.14)pg/mL,(2.52±0.87)pg/mL,t值分别为10.32,7.29,2.90,P值均<0.05]。 结论 miR-142-3p通过负调控HMGB1/TLR4/NF-κB通路减轻尘螨引起的儿童过敏性气道炎症。 Abstract:Objective To investigate the role of miR-142-3p in alleviation of house dust mite-induced allergic airway inflammation among children, so as to provide insights into unraveling the pathogenesis of allergic airway inflammation. Methods Serum samples were collected from 15 patients with house dust mite-induced allergic asthma and 15 healthy children in Jiangnan University Medical Center from September to November 2022, and serum miR-142-3p expression was quantified using a fluorescent quantitative real-time PCR (qPCR) assay. The levels of interleukin-6 (IL-6) and tumor necrosis factor-α (TNF-α) were measured in the cell culture supernatant using enzyme-linked immunosorbent assay (ELISA), and the expression of high mobility group box 1 (HMGB1) was detected at transcriptional and translational lvels using qPCR and Western blotting assays. The negative regulation of the HMGB1 gene by miR-142-3p was identified using a dual luciferase gene reporter assay, and the expression of downstream regulatory proteins was determined in human normal lung epithelial cells (BEAS-2B) cells transfected with miR-142-3p using Western blotting. In addition, female C57BL/6 mice at ages of 6-8 weeks were randomly assigned to the phosphate buffer saline (PBS) group, house dust mite-sensitized airway inflammation group and house dust mite-sensitized airway inflammation + miR-142-3p intervention group. Mouse airway inflammation was evaluated using hematoxylin-eosin staining, and the expression of inflammatory cells and inflammatory cytokines were detected in mouse bronchoalveolar lavage fluid (BALF) using Giemsa staining and ELISA. Results Lower serum miR-142-3p expression was quantified among children with house dust mite-induced allergic asthma than among healthy controls (1.33±0.21 vs. 4.74±0.62, t=5.22, P < 0.05). Stimulation with dermatophagoides farinae extract (DFE) resulted in a reduction in miR-142-3p expression in BEAS-2B cells (0.82±0.25), while transfection with miR-142-3p mimics resulted in a rise in miR-142-3p expression in BEAS-2B cells (0.55±0.14)(t=3.31, 3.94, P < 0.05). Pre-treatment with miR-142-3p reduced the expression of IL-6(2.25±0.46)and TNF-α(6.58±1.95) (t=4.86, 3.38, P < 0.05) in BEAS-2B cells stimulated with DFE, and treatment with miR-142-3p mimics resulted in a reduction in TLR4 and NF-κB expression in BEAS-2B cells via negative regulation of the HMGB1 expression. In addition, treatment with miR-142-3p was found to alleviate inflammatory cell infiltration in lung tissues of house dust mite-sensitized mice, and results in a reduction in interleukin-4 (IL-4)[(107.60±10.43)pg/mL], interleukin-5 (IL-5)[(95.78±13.14)pg/mL] and HMGB1[(2.52±0.87)pg/mL] expression in BALF (t=10.32, 7.29, 2.90, P < 0.05). Conclusion miR-142-3p alleviates house dust mite-induced allergic airway inflammation among children via negative regulation of the HMGB1/TLR4/NF-κB pathway. 1) 利益冲突声明 所有作者声明无利益冲突。 -
哮喘是一种常见的呼吸系统慢性炎症性疾病[1],中国目前约有3 000万哮喘患者[2]。既往研究表明,哮喘是一种异质性疾病,其中过敏性哮喘是最主要的表型,成年人哮喘中超过50%为过敏性哮喘,儿童哮喘中该比例更高达80%以上[3]。尘螨是引起儿童过敏性哮喘的主要吸入性过敏原,过敏性哮喘的发生和发展与尘螨致敏密切相关[4]。过敏性哮喘反复发作严重影响儿童睡眠、学习以及生长发育,给患儿家庭带来了巨大经济压力和心理负担[5]。因此,探索尘螨致敏机制可为呈现出异质性特征的儿童哮喘诊断和治疗提供新思路[6]。
微小RNA(microRNA, miRNA)是一类非编码RNA,在转录后调控中发挥广泛作用,参与生长发育、肿瘤发生与发展、免疫和炎症等多种生命过程[7]。miR-142-3p在骨关节炎、系统性红斑狼疮和脓毒症等炎症相关疾病中发挥了重要的炎症调节作用[8-10]。此外,miR-142-3p还可以调节气道平滑肌细胞增殖、抑制气道重塑过程[11]。气道炎症反应是哮喘的主要表型和发病原因[12];而气道上皮细胞作为密闭的第一道防线,扮演着自我清洁功能的角色,并最先接触过敏原侵袭和接触雾化药物治疗[13]。本研究用粉尘螨粗提液致敏气道炎症模型,探索miR-142-3p在尘螨诱导的过敏性气道炎症中的作用及其机制,为探究儿童过敏性哮喘发病机制提供借鉴。
1. 材料与方法
1.1 材料
1.1.1 血清样本
收集2022年9—11月在江南大学附属中心医院就诊的15例2~10岁粉尘螨过敏哮喘儿童的血清,患者均经Immuno CAPTM检测系统(美国Pharmacia Upjohn公司)测定血清抗粉尘螨特异性免疫球蛋白E(immunoglobulin E, IgE)抗体确诊,收集同期经Immuno CAPTM法检测结果为阴性的15例1~10岁健康儿童血清作为阴性对照。本研究获得江南大学附属中心医院伦理委员会批准(批准号:2022-Y-76)。动物实验严格遵循3R(Reducing, Reusing, Recycling)原则和有关实验动物使用和管理的国际、国内法律、法规和指南进行;人体研究符合《赫尔辛基指南》和涉及人体的生命科学和医学研究相关规范,患者监护人均知情同意。
1.1.2 实验动物和细胞
6~8周龄雌性C57BL/6小鼠购自扬州大学比较医学中心,饲养环境为无特定病原体(SPF)级,饲养温度为(22±1)℃、相对湿度为(50±1)%、光/暗周期为12/12 h。人正常肺上皮细胞(human normal lung epithelial cells, BEAS-2B)购自武汉普诺赛公司,使用Dulbecco的改良Eagle培养基(Dulbecco's Modified Eagle Medium,DMEM)(培养基含10%胎牛血清,1%青/链霉素)在37 ℃、含5% CO2培养箱培养。
1.1.3 主要仪器与试剂
DMEM细胞培养基、胎牛血清、青/链霉素购自美国Gibco公司;粉尘螨粗提液(dermatophagoides farinae extract,DFE)为美国Greer公司生产,购自北京博蕾德科技发展有限公司;miRNA mimics、对照序列miR-NC、激动剂及转染试剂购自广州锐博公司;酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒购自北京四正柏生物公司;细胞计数试剂(cell counting kit-8,CCK-8)试剂购自碧云天生物技术公司,RNAiso PLUS RNA提取试剂为TAKARA公司产品;反转录试剂及定量聚合酶联反应(polymerase chain reaction,PCR)试剂购自北京全式金生物公司,定量PCR仪器型号为ABI7500;Western blotting抗体购自Abcam公司,检测试剂购自Thermo公司,其他相关辅助试剂购自北京索莱宝公司;双荧光素酶基因报告检测使用Promega试剂。苏木精-伊红(hematoxylin-eosin, HE)染色液购自北京中杉金桥公司,组织染片使用Olympus显微镜观察拍摄。
1.2 方法
1.2.1 尘螨致敏气道炎症小鼠模型干预
C57BL/6小鼠随机分为3组,每组6只,分组如下:(1)磷酸缓冲盐溶液(phosphate buffer saline, PBS)组为阴性对照组;(2)DFE处理组为致敏组;(3)DFE致敏+miR-142-3p干预组。致敏方式采取经鼻滴入DFE:40 μL DFE在第1 d以2.5 μg/μL质量体积浓度重悬于PBS中滴鼻,阴性对照组使用相同体积PBS。自第7 d开始,每天进行1次滴鼻,连续5 d,每日用量10 μg,总滴入量40 μL。其中第3组在第6天腹腔注射miR-142-3p激动剂。动物实验进行到第14 d时,收集小鼠支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF),取小鼠肺组织进行病理学检测。
1.2.2 组织和细胞染色
小鼠肺组织用4%多聚甲醛固定、脱水、石蜡包埋。将小鼠肺组织切成4 μm切片,HE染色,操作按试剂盒说明书进行。收集到的BALF以800 r/min(离心半径10.5 cm)离心5 min后,收集沉淀,采用瑞氏吉姆萨染色液染色。
1.2.3 尘螨致敏细胞模型干预
将BEAS-2B细胞使用DFE致敏,分组如下:(1)正常培养细胞BEAS-2B;(2)DFE处理BEAS-2B细胞(BEAS-2B+DFE);(3)BEAS-2B细胞使用miR-142-3p mimics预处理后,加入DFE刺激(BEAS-2B-miR-142-3p+DFE)。DFE处理浓度为20 μg/mL;第3组是细胞在细胞传代12 h后,使用转染试剂按操作步骤转染miR-142-3p mimics,转染后24 h采用DFE处理。收集处理后的细胞和培养上清用于进一步实验分析。
1.2.4 定量PCR检测
采用实时荧光定量PCR(quantitative real-time PCR,qPCR)法检测儿童血清及1.2.3方法中所述3组细胞中miR-142-3p及高迁移率族蛋白B1(high mobility group box 1, HMGB1)表达水平。应用RNAiso PLUS提取血清或者细胞中RNA,提取后反转录为cDNA,使用SYBR GREEN试剂进行定量验证。qPCR反应体系:95 ℃变性5 min;95 ℃ 15 s,60 ℃ 1 min,共40个循环。采用2-△△ct法计算所测基因相对表达量[14]。检测miR-142-3p表达时,使用茎环定量PCR法,反转录使用的茎环引物序列:5′-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGT-CCATAAA-3′。miR-142-3p引物序列:F,5′-ACACTCCAGCTGGGTGTAGTGTTTCCTACT-3′;R,5′-TGGTGTC GTGGAGTCG-3′。miRNA测定时内参选用U6,引物序列:F,5′-CTCGCTTCGGCAGCACA-3′;R,5′-AACGCTT CACGAATTTGCGT-3′。HMGB1引物序列:F,5′-GCGA AGAAACTGGGAGAGATGT-3′;R,5′-GCATCAGGCTTT CCTTTAGCTCG-3′。定量PCR所使用内参为β-肌动蛋白(β-actin),引物序列:F,5′-TCATGAAGTGTGACGTTGACATCCG-3′;R,5′-CCTAGAAGCATTTGCGGTGCACGATG-3′。
1.2.5 CCK-8检测
BEAS-2B和转染miR-142-3p后的细胞分别经DFE处理24,48,72 h后,使用CCK-8试剂检测细胞存活率,并在450 nm波长处使用酶标仪读取A值。
1.2.6 ELISA检测
患儿血清标本中HMGB1,小鼠BALF中HMGB1、白细胞介素-4(interleukin-4, IL-4)及白细胞介素-5(interleukin-5, IL-5),细胞上清中的白细胞介素-6(interleukin-6, IL-6)及肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)分别使用人源性及鼠源性ELISA试剂盒测定。检测步骤为:ELISA板每孔加入100 μL待测标本,37 ℃孵育1 h,洗板4次后,依次加入酶及显色液,随后使用终止液终止反应,在450 nm波长处读取A值。
1.2.7 Western blotting检测
使用RIPA蛋白裂解液和蛋白酶抑制剂裂解提取蛋白后,进行Western blotting检测。步骤如下:待测蛋白经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)胶分离后,转移到聚偏二氟乙烯膜(polyvinylidene fluoride, PVDF膜)上。膜在室温下用5%的脱脂牛奶封闭2 h,随后,4 ℃下与对应一抗孵育过夜。含吐温-20的磷酸盐缓冲液(phosphate buffered saline with Tween-20,PBST)清洗一抗后,PVDF膜与相应二抗,室温下孵育2 h,加入增强型化学发光试剂(enhanced chemiluminescence,ECL)液,经由曝光仪观察条带。核因子-κB(nuclear factor-kappa B, NF-κB)分子量为65 KD;β-actin分子量为42 KD;HMGB1分子量为25 KD;Toll-样受体4蛋白(Toll-like receptor protein 4, TLR4)分子量为96 KD。
1.2.8 双荧光素酶报告基因方法检测
经Target Scan和Pic Tar软件预测到HMGB1是miR-142-3p的靶基因。扩增HMGB1的3′非翻译区WT,克隆到pMIR-REPORT载体上荧光素酶报告基因上游。同时扩增HMGB1 3′非翻译区的突变序列MUT,该序列与miR-142-3p结合位点发生改变,克隆到pMIR-REPORT载体。荧光检测时候选用PGL 4.74质粒转染做内参质粒。上述质粒连同miR-142-3p mimics或miR-NC转染至BEAS-2B细胞中,转染后48 h,在GloMax® 96 Luminometer仪器中进行荧光检测。
1.3 统计学方法
采用SPSS 18.0软件进行统计分析,计量资料采用(x±s)表示,组间比较使用t检验。以P<0.05为差异有统计学意义。文章中柱形图和折线图使用GraphPad Prism 5进行绘制,图片使用Adobe PhotoShop进行整合处理。
2. 结果
2.1 尘螨过敏哮喘患儿血清中miR-142-3p表达水平
qPCR法检测显示,尘螨过敏哮喘患儿血清中miR-142-3p表达水平为(1.33±0.21),低于健康儿童对照血清(4.74±0.62),差异有统计学意义(t=5.22,P值均<0.05)。
2.2 miR-142-3p降低尘螨致敏气道上皮细胞BEAS-2B炎症反应
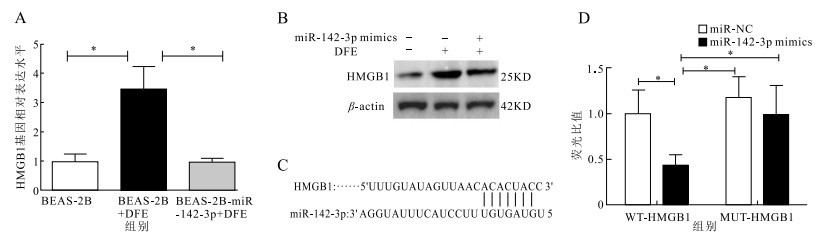
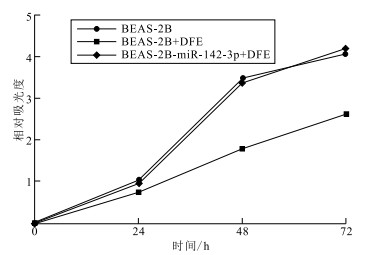
qPCR检测发现,经DFE刺激后,miR-142-3p表达水平由(1.21±0.23)降低至(0.39±0.07),降低了(0.82±0.25);加入miR-142-3p mimics后,表达水平恢复至(0.94±0.10),提升了(0.55±0.14)(t值分别为3.31,3.94,P值均<0.05)。见表 1。BEAS-2B细胞加入DFE刺激后,细胞在48,72 h活性较未刺激组分别降低(1.70±0.11)(1.46±0.07);预转染miR-142-3p后,经DFE刺激,BEAS-2B在48,72 h活性较BEAS-2B+DFE组分别提升(1.60±0.08)(1.57±0.10)(t值分别为15.45,21.20;18.82,15.83,P值均<0.05)(图 1)。
表 1 miR-142-3p减轻DFE刺激下BEAS-2B细胞中炎症因子表达水平(x±s)Table 1. miR-142-3p in reducing the expression of inflam- matory factors in BEAS-2B cells under DFE stimulation (x±s)组别 miR-142-3p TNF-α IL-6 BEAS-2B 1.21±0.23 1.14±0.08 1.03±0.15 BEAS-2B+DFE 0.39±0.07 10.80±1.88 4.18±0.45 BEAS-2B-miR-142-3p+DFE 0.94±0.10 4.22±0.51 1.93±0.88 ELISA检测BEAS-2B细胞不同处理后,IL-6、TNF-α表达水平。DFE刺激后,BEAS-2B细胞上清中炎症因子IL-6、TNF-α表达水平分别增高(3.15±0.48)(9.66±1.88);预转染miR-142-3p后经DFE刺激,BEAS-2B细胞上清中炎症因子IL-6、TNF-α表达水平较单纯DFE刺激分别降低(2.25±0.46)(6.58±1.95)(t值分别为6.60,5.14,4.86,3.38,P值均<0.05)。见表 1。
2.3 miR-142-3p调控HMGB1影响DFE对BEAS-2B细胞致敏作用
DFE处理BEAS-2B后HMGB1基因水平和蛋白水平均增高,预转染miR-142-3p mimics后基因和蛋白表达水平恢复(图 2A、2B)。使用TargetScan和Pic Tar软件,预测miR-142-3p可以与HMGB1的3'UTR区的ACACUAC结合(图 2C)。双荧光素酶基因报告系统检测:与转染无关miR-NC相比,miR-142-3p可以降低转染HMGB1 3'UTR WT组荧光表达,使荧光相对值下降(0.55±0.11)(t=4.87,P<0.05);转染HMGB1 3'UTR MUT组中,miR-142-3p荧光值变化无统计学意义(P>0.05)(图 2D)。
2.4 尘螨过敏哮喘患儿血清中HMGB1表达及细胞中HMGB1下游调控蛋白变化
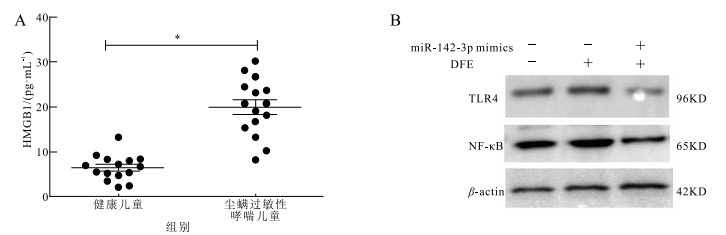
ELISA检测结果显示,所测尘螨过敏哮喘患儿血清中HMGB1表达水平较健康儿童高(19.95±1.66,6.45±0.74)pg/mL(t=7.44,P<0.05)(图 3A)。Western blotting法检测DFE处理BEAS-2B细胞以及加入miR-142-3p干预后,HMGB1下游调控蛋白TLR4和NF-κB表达变化。图 3B显示DFE处理BEAS-2B细胞组,TLR4和NF-κB蛋白表达水平增高,加入miR-142-3p mimics预处理后,DFE处理BEAS-2B中TLR4和NF-κB蛋白表达水平降低。
2.5 miR-142-3p减轻尘螨致敏哮喘小鼠气道炎症反应
见表 2。
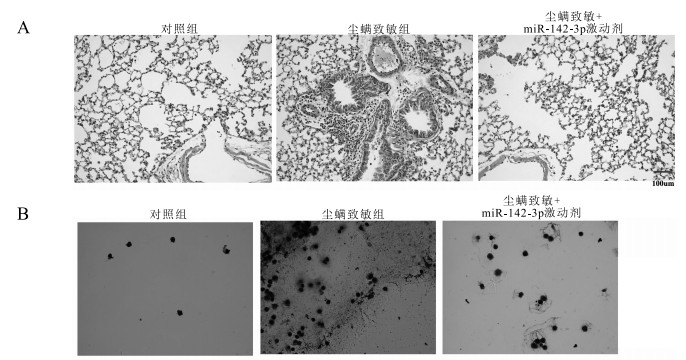
表 2 miR-142-3p减轻尘螨致敏小鼠BALF中炎症因子表达水平比较[(x±s),pg/mL]Table 2. miR-142-3p in reducing the expression of inflammat- ory factors in BALF of house dust mite mice[(x±s), pg/mL]组别 IL-4 IL-5 HMGB1 对照组 26.45±3.88 40.82±3.59 0.82±0.13 尘螨致敏组 173.10±8.84 144.20±11.99 8.03±0.82 尘螨致敏+miR-142-3p激动剂组 65.50±5.52 48.37±5.37 6.00±0.51 HE染色结果显示,与对照组小鼠相比,尘螨致敏小鼠气道周边炎症细胞浸润显著增加,气道黏液分泌增加;加入miR-142-3p激动剂干预后,尘螨致敏小鼠上述炎症反应减轻(图 4A)。瑞氏-吉姆萨染色显示,尘螨致敏小鼠BALF中细胞总数增加,miR-142-3p激动剂预处理组细胞总数较单纯尘螨处理组降低(图 4B)。ELISA结果显示,尘螨致敏小鼠BALF中IL-4、IL-5及HMGB1表达水平较对照组增高(146.60±9.66)(103.30±12.51)(7.21±0.83)pg/mL,加入miR-142-4p预处理后上述炎症因子表达较尘螨致敏小鼠降低[(107.60±10.43)(95.78±13.14)(2.52±0.87)pg/mL](t值分别为15.18,8.26,8.67;10.32,7.29,2.90,P值均<0.05)。见表 2。
3. 讨论
支气管哮喘是儿童时期最常见的慢性气道炎症[15]。我国儿童哮喘患病率逐年上升,已从2000年的1.97%增长到2010年的3.02%,呈逐年上升趋势,上海市更高达7.57%,给患儿和家庭带来沉重的精神和经济负担[16]。目前,哮喘的常用治疗药物为固醇类药物,但其引发的不良反应较多;此外,哮喘治疗疗程长,患儿依从性不佳[17]。上述因素导致儿童哮喘控制欠佳、预后不良[18]。探索针对儿童过敏性哮喘进行预防和控制的新诊疗方式,对当前基础研究提出了较大挑战。既往研究表明,miRNA在哮喘进程中参与调控气道高反应性、气道炎症及在气道重塑方面发挥重要作用[19]。本研究细胞实验和动物实验结果证实,miR-142-3p可以抑制尘螨诱导的过敏性小鼠模型气道炎症反应和气道上皮细胞BEAS-2B炎症因子表达;双荧光素酶报告实验表明,miR-142-3p通过负调控HMGB1抑制下游调控通路TLR4/NF-κB蛋白变化,发挥其抗炎作用。
miR-142-3p在炎症相关疾病发生发展过程中起重要作用[9-11]。Guiot等[11]研究显示,巨噬细胞来源外泌体能通过输送miR-142-3p到肺泡上皮细胞发挥抗炎和抗纤维化作用。Qing等[20]发现,miR-142-3p可以通过LPS-TLR-TNF-α信号通路调控鼻息肉伴发慢性鼻炎的炎症进程。Wang等[8]报道,miR-142-3p可通过负调控HMGB1基因和蛋白表达减轻软骨细胞凋亡,从而发挥抗骨关节炎作用。此外,miR-142-3p可通过抑制转化生长因子-β(TGF-β)调控的表皮生长因子受体(EGFR)信号通路或WNT信号通路减轻支气管平滑肌重塑,从而降低哮喘进展过程的气道高反应性[21]。而中药冰片通过miR-142-3p降低哮喘过程中CD4+T细胞浸润,减轻炎症反应[22]。本研究发现,尘螨过敏哮喘儿童血清中miR-142-3p表达水平降低,并且过表达miR-142-3p可减轻尘螨致敏造成的小鼠气道炎症反应,提示miR-142-3p是治疗尘螨过敏性哮喘的候选靶点。
HMGB1是高度保守核蛋白家族成员之一,作为一种重要的内源性炎症性介质,在多种炎症性疾病中发挥重要作用[23]。在气道炎症发生发展过程中,HMGB1与气道炎症和肺功能损害程度呈正相关[24],降低HMGB1表达可阻止HMGB1核质转移或释放,从而显著减轻气道炎症反应[25]。在香烟烟雾引起的慢性阻塞性肺疾病模型中,作为损伤相关分子模式,HMGB1通过结合TLR4募集髓样分化因子-88(Myd88),激活下游NF-κB转录因子,使其核转移,促进炎症因子释放[26]。此外,HMGB1可与晚期糖基化终产物RAGE受体结合,通过丝裂原活化蛋白激酶(MAPK)和胞外信号调节蛋白1和2(ERK1/2)信号通路调控炎症因子释放,发挥促炎作用[27]。本研究证实,尘螨刺激气道上皮细胞后,miR-142-3p过表达可以抑制HMGB1表达,双荧光素酶实验证实两者间存在直接调控关系,并检测到HMGB1下游常见调控蛋白TLR4和NF-κB表达变化。
-
表 1 miR-142-3p减轻DFE刺激下BEAS-2B细胞中炎症因子表达水平(x±s)
Table 1. miR-142-3p in reducing the expression of inflam- matory factors in BEAS-2B cells under DFE stimulation (x±s)
组别 miR-142-3p TNF-α IL-6 BEAS-2B 1.21±0.23 1.14±0.08 1.03±0.15 BEAS-2B+DFE 0.39±0.07 10.80±1.88 4.18±0.45 BEAS-2B-miR-142-3p+DFE 0.94±0.10 4.22±0.51 1.93±0.88 表 2 miR-142-3p减轻尘螨致敏小鼠BALF中炎症因子表达水平比较[(x±s),pg/mL]
Table 2. miR-142-3p in reducing the expression of inflammat- ory factors in BALF of house dust mite mice[(x±s), pg/mL]
组别 IL-4 IL-5 HMGB1 对照组 26.45±3.88 40.82±3.59 0.82±0.13 尘螨致敏组 173.10±8.84 144.20±11.99 8.03±0.82 尘螨致敏+miR-142-3p激动剂组 65.50±5.52 48.37±5.37 6.00±0.51 -
[1] HOLGATE S T, WENZEL S, POSTMA D S, et al. Asthma[J]. Nat Rev Dis Primers, 2015, 1(1): 15025. doi: 10.1038/nrdp.2015.25 [2] HUANG K, YANG T, XU J, et al. Prevalence, risk factors, and management of asthma in China: a national cross-sectional study[J]. Lancet, 2019, 394(10196): 407-418. doi: 10.1016/S0140-6736(19)31147-X [3] KANAGARATHAM C, RADZIOCH D. Allergic asthma: a summary from genetic basis, mouse studies, to diagnosis and treatment[J]. Curr Pharm Des, 2016, 22(41): 6261-6272. doi: 10.2174/1381612822666160829141708 [4] THOMAS W R, HALES B J, SMITH W A. House dust mite allergens in asthma and allergy[J]. Trends Mol Med, 2010, 16(7): 321-328. doi: 10.1016/j.molmed.2010.04.008 [5] SHIPP C L, GERGEN P J, GERN J E, et al. Asthma management in children[J]. J Allergy Clin Immunol Pract, 2023, 11(1): 9-18. doi: 10.1016/j.jaip.2022.10.031 [6] GAN H, LUO W, HUANG Z, et al. House dust mite components sensitization profile in China, a multi-centre study[J]. Clin Exp Allergy, 2023, 53(2): 226-229. doi: 10.1111/cea.14255 [7] SALIMINEJAD K, KHORRAM KHORSHID H R, SOLEYMANI FA-RD S, et al. An overview of microRNAs: biology, functions, therapeutics, and analysis methods[J]. J Cell Physiol, 2019, 234(5): 5451-5465. doi: 10.1002/jcp.27486 [8] WANG X, GUO Y, WANG C, et al. microRNA-142-3p inhibits cho-ndrocyte apoptosis and inflammation in osteoarthritis by targeting HMGB1[J]. Inflammation, 2016, 39(5): 1718-1728. doi: 10.1007/s10753-016-0406-3 [9] WANG Y, LIANG J, QIN H, et al. Elevated expression of miR-142-3p is related to the pro-inflammatory function of monocyte-derived dendritic cells in SLE[J]. Arthritis Res Ther, 2016, 18(1): 263. doi: 10.1186/s13075-016-1158-z [10] WU M, HUANG Z, HUANG W, et al. microRNA-124-3p attenuates myocardial injury in sepsis via modulating SP1/HDAC4/HIF-1α axis[J]. Cell Death Discov, 2022, 8(1): 40. doi: 10.1038/s41420-021-00763-y [11] GUIOT J, CAMBIER M, BOECKX A, et al. Macrophage-derived exosomes attenuate fibrosis in airway epithelial cells through delivery of antifibrotic miR-142-3p[J]. Thorax, 2020, 75(10): 870-881. doi: 10.1136/thoraxjnl-2019-214077 [12] KLEINJAN A. Airway inflammation in asthma: key players beyond the Th2 pathway[J]. Curr Opin Pulm Med, 2016, 22(1): 46-52. doi: 10.1097/MCP.0000000000000224 [13] DAVIS J D, WYPYCH T P. Cellular and functional heterogeneity of the airway epithelium[J]. Mucosal Immunol, 2021, 14(5): 978-990. doi: 10.1038/s41385-020-00370-7 [14] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2[-Delta Delta C(T)] Method[J]. Methods, 2001, 25(4): 402-408. doi: 10.1006/meth.2001.1262 [15] BEREDA G. Bronchial asthma: etiology, pathophysiology, diagnosis and management[J]. Austin J Pulm Respir Med, 2022, 9(1): 1085. [16] LI X, SONG P, ZHU Y, et al. The disease burden of childhood asthma in China: a systematic review and Meta-analysis[J]. J Glob Health, 2020, 10(1): 010801. doi: 10.7189/jogh.10.010801 [17] MAUER Y, TALIERCIO R M. Managing adult asthma: the 2019 GINA guidelines[J]. Cleve Clin J Med, 2020, 87(9): 569-575. doi: 10.3949/ccjm.87a.19136 [18] SIMONEAU T, CLOUTIER M M. Controversies in pediatric asthma[J]. Pediatr Ann, 2019, 48(3): e128-e134. [19] WEIDNER J, BARTEL S, KILIÇ A, et al. Spotlight on microRNAs in allergy and asthma[J]. Allergy, 2021, 76(6): 1661-1678. doi: 10.1111/all.14646 [20] QING X, ZHANG Y, PENG Y, et al. Mir-142-3p regulates inflammatory response by contributing to increased TNF-α in chronic rhinosinusitis with nasal polyposis[J]. Ear Nose Throat J, 2021, 100(1): NP50-NP56. doi: 10.1177/0145561319847972 [21] BARTEL S, CARRARO G, ALESSANDRINI F, et al. miR-142-3p is associated with aberrant WNT signaling during airway remodeling in asthma[J]. Am J Physiol Lung Cell Mol Physiol, 2018, 315(2): L328-L333. doi: 10.1152/ajplung.00113.2018 [22] WANG J Y, DONG X, YU Z, et al. Borneol inhibits CD4+ T cells proliferation by down-regulating miR-26a and miR-142-3p to attenuate asthma[J]. Int Immunopharmacol, 2021, 90: 107223. doi: 10.1016/j.intimp.2020.107223 [23] DUMITRIU I E, BARUAH P, MANFREDI A A, et al. HMGB1: an immmune odyssey[J]. Discov Med, 2005, 5(28): 388-392. [24] ZHAO Y, LI R. HMGB1 is a promising therapeutic target for asthma[J]. Cytokine, 2023, 165: 156171. doi: 10.1016/j.cyto.2023.156171 [25] KO H K, HSU W H, HSIEH C C, et al. High expression of high-mobility group box 1 in the blood and lungs is associated with the development of chronic obstructive pulmonary disease in smokers[J]. Respirology, 2014, 19(2): 253-261. doi: 10.1111/resp.12209 [26] CHENG Y, WANG D, WANG B, et al. HMGB1 translocation and release mediate cigarette smoke-induced pulmonary inflammation in mice through a TLR4/MyD88-dependent signaling pathway[J]. Mol Biol Cell, 2017, 28(1): 201-209. doi: 10.1091/mbc.e16-02-0126 [27] HUANG W F, ZHAO H J, DONG H M, et al. High-mobility group box 1 impairs airway epithelial barrier function through the activation of the RAGE/ERK pathway[J]. Int J Mol Med, 2016, 37(5): 1189-1198. doi: 10.3892/ijmm.2016.2537 -






 下载:
下载:




 下载:
下载: